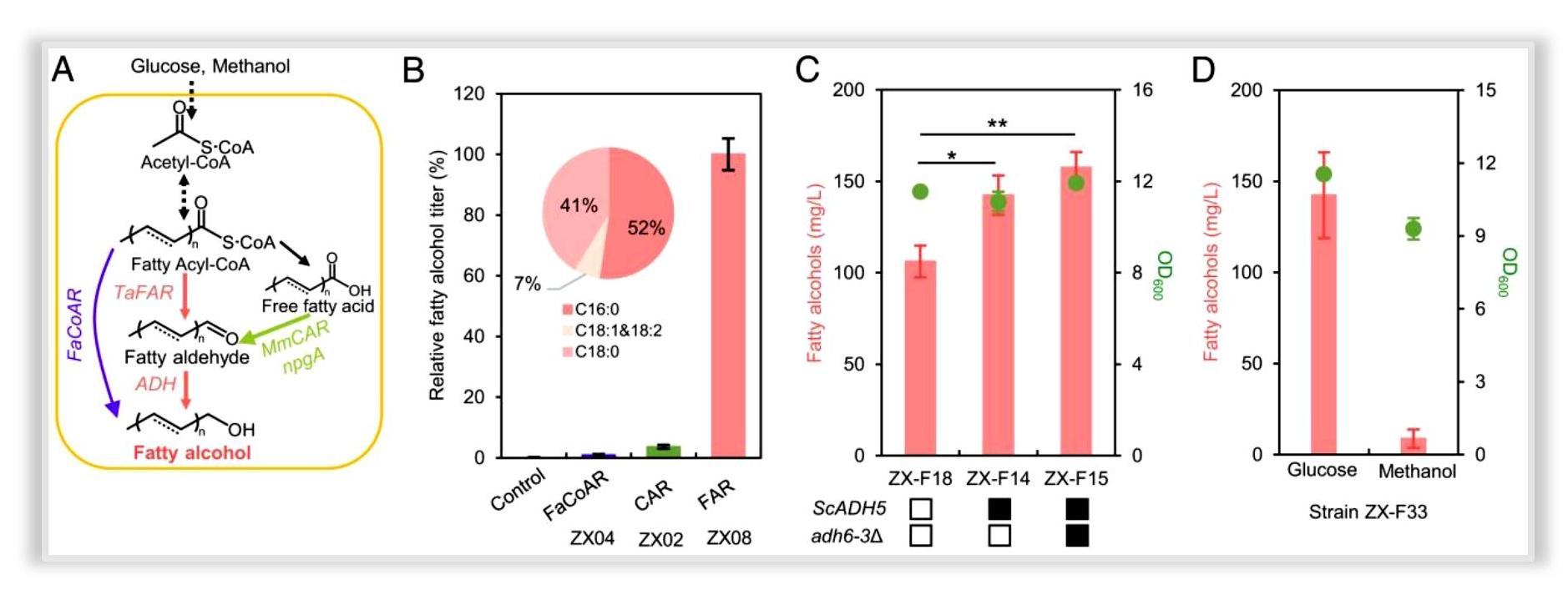
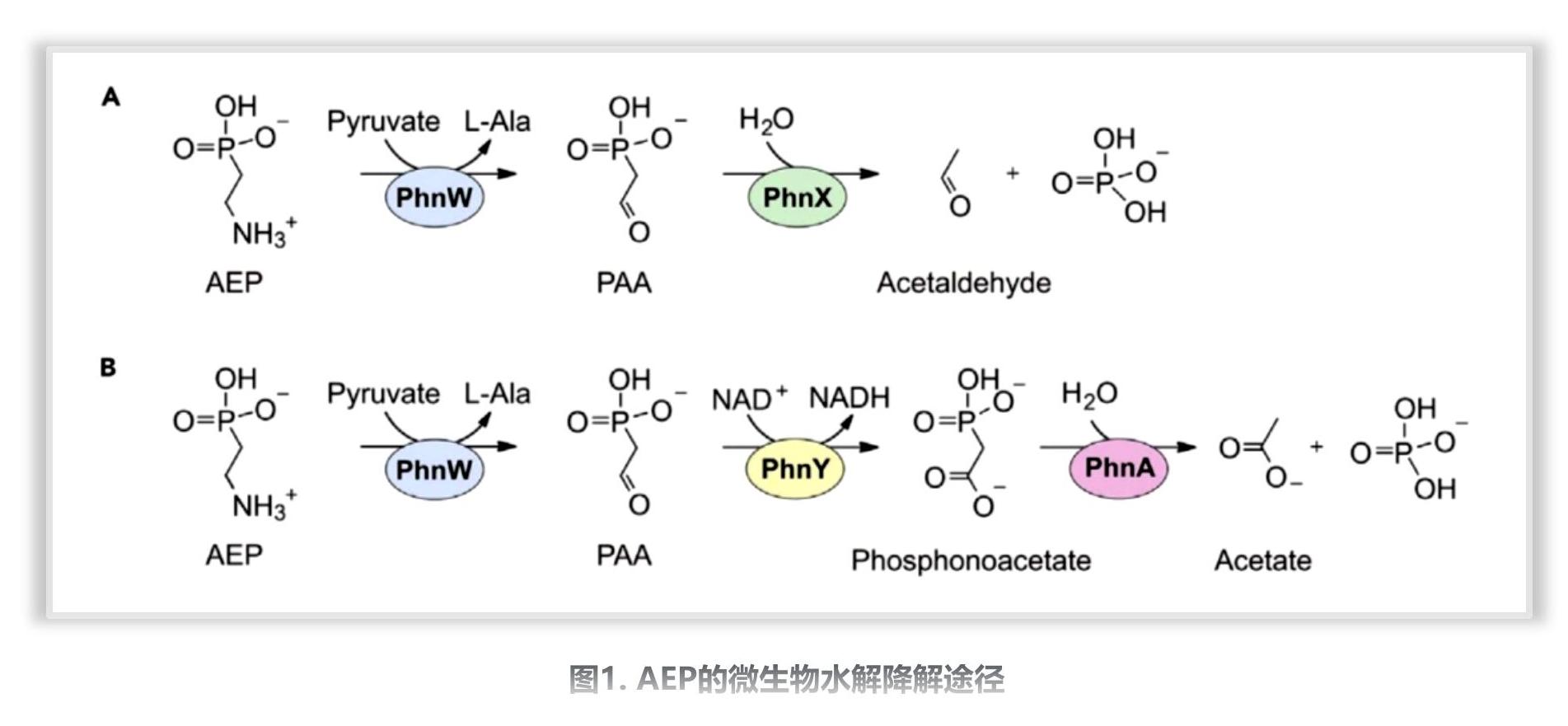
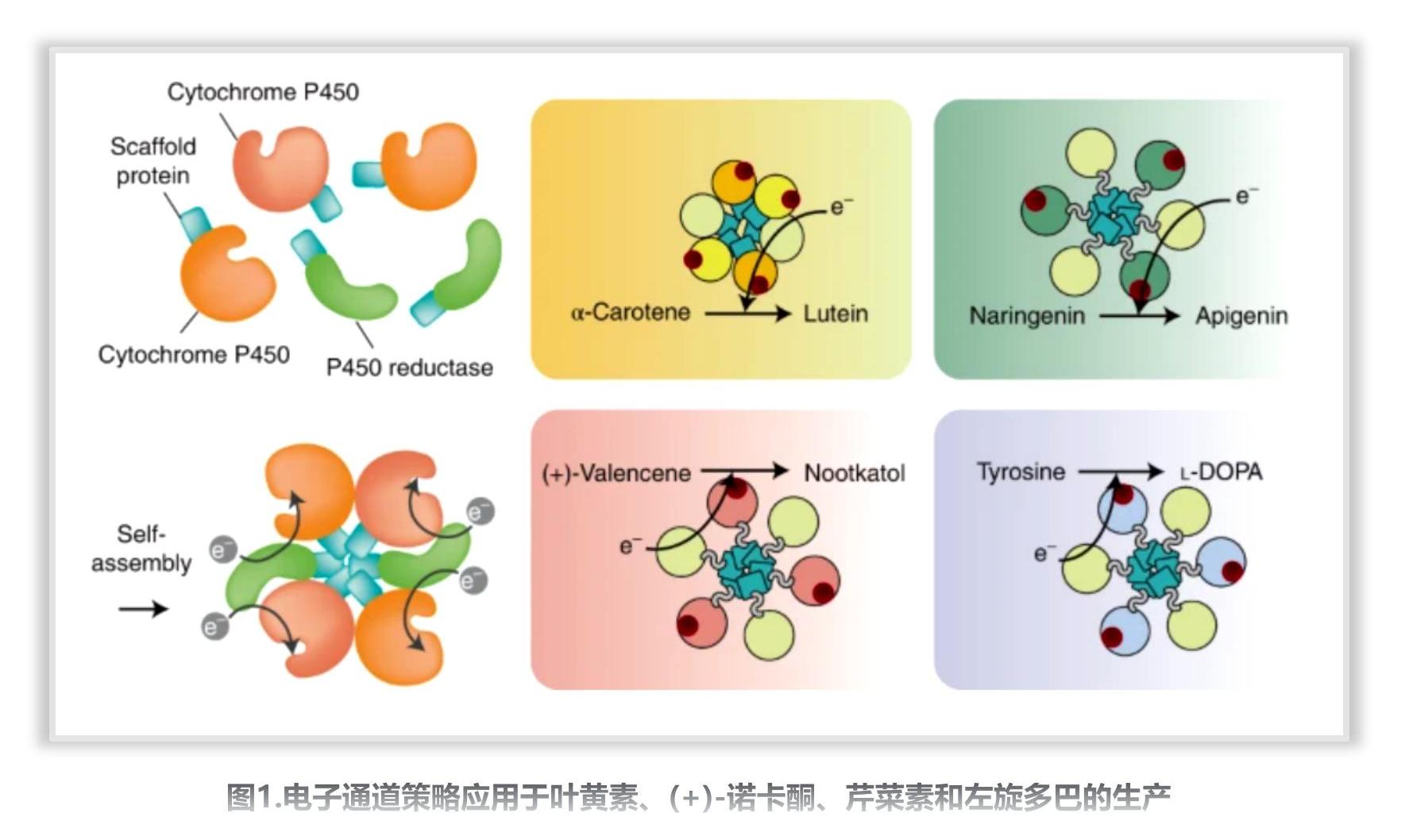
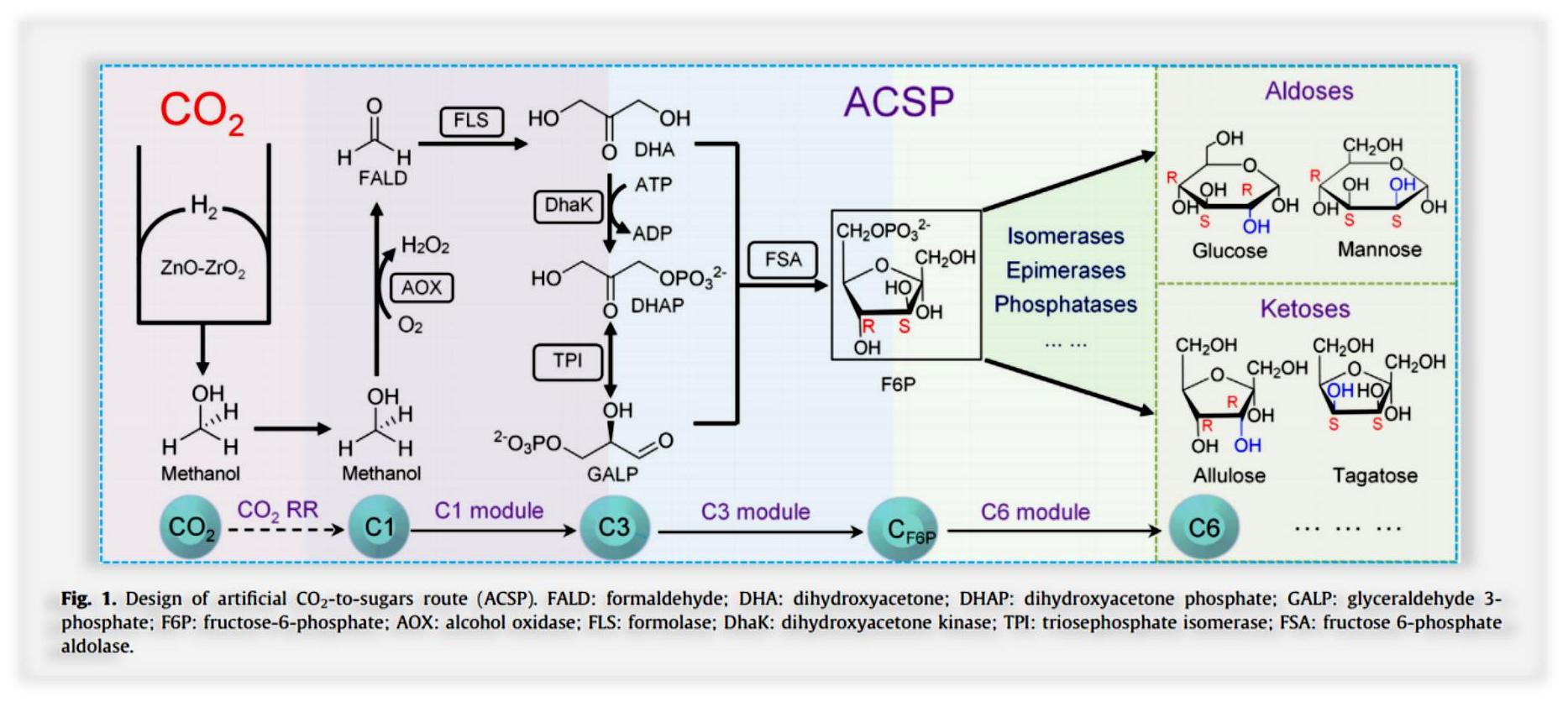
新闻动态
锐谈 | ACS OMEGA:理性改造L-哌啶酸羟化酶的可溶性表达
- 分类:新闻动态
- 作者:迪迦
- 来源:https://pubs.acs.org/doi/10.1021/acsomega.2c04247
- 发布时间:2023-01-11 13:48
- 访问量:
锐谈 | ACS OMEGA:理性改造L-哌啶酸羟化酶的可溶性表达
【概要描述】
- 分类:新闻动态
- 作者:迪迦
- 来源:https://pubs.acs.org/doi/10.1021/acsomega.2c04247
- 发布时间:2023-01-11 13:48
- 访问量:
详情
1.降低培养温度和改变培养基组分来优化培养条件;
2.密码子优化;
3.与伴侣蛋白的共表达;
4.使用不同强度的启动子来控制蛋白质合成速度。

(1)亲水性矛盾法则:
如果靶蛋白的残基是亲水的,而共识蛋白的残基是疏水的,则得分为负,如果相反,得分为正。因此,分数通过将它们与一致的氨基酸残基进行比较来识别具有矛盾疏水性的残基。
(2)α-螺旋法则:
将存在于α-螺旋的亲水区的疏水氨基酸转化为亲水性氨基酸,或将疏水性区域中的亲水性氨基酸转化为疏水性氨基酸。




原文链接:https://pubs.acs.org/doi/10.1021/acsomega.2c04247

关键词:
搜索


×
搜索
版权所有 © 2022 上海锐康生物技术研发有限公司